-
Постов
2233 -
Зарегистрирован
-
Посещение
-
Победитель дней
15
Тип контента
Профили
Форумы
События
Весь контент pauk
-
Можно, конечно, налить в колбу с эфиром раствор щёлочи, заткнуть её пальцем и ждать, пока всё устаканится. Но лучше всё же греть колбу до кипения РМ. Старик Вант-Гофф не даст соврать.
-
Мне легче отодрать от кубика Рубика все цветные накладки, а потом заново наклеить их в нужном порядке, чем собирать его.
-
Что именно, крест или голимую математику?
-
Лёд, вода и пар с точки зрения непосвящённого - это три разные сущности. Для первого случая они на тюбике писали бы "морозостойкий" или "морозоустойчивый", а для последнего - "паростойкий". Кстати, есть и такой термин. Я смотрел в интернете, есть даже такой нормируемый параметр: "паростойкость клеевого шва" (только там было не про дерево, но какая, в принципе, разница)
-
Да? А чего же тогда при катастрофических наводнениях и извержениях вулканов все бегут и орут, а не хрустят попкорном, спокойно взирая на катаклизм?
-
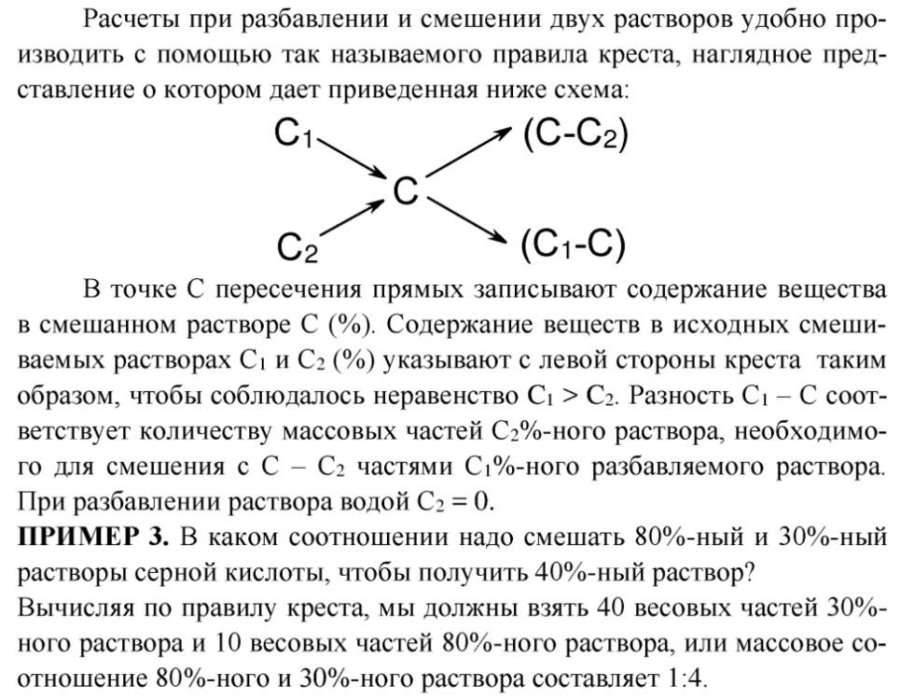
Задания быстро решаются с помощью т. н. "правила креста". Только надо помнить, что при использования этого правила все значения должны выражаться в единицах массы, а не объёма. Поэтому в задании 2) надо предварительно пересчитать объём раствора на его массу: m = pV. Если такой вариант не устраивает, то решайте задания стандартным методом через нахождение масс растворённого вещества в исходных, добавляемых и конечных растворах, составление пропорций и т. д.
-
Видите ли, уважаемый доцент, это объяснение на пальцах адресовано начинающим изучать азы химии. Мне кажется, что описывать эту реакцию с привлечением констант равновесия для школьника - гиблое дело. Он ещё нарешается таких задач, если поступит в химический вуз и будет проходить там курс аналитики. А если не поступит, то на фиг оно ему и надо.
-
H3BO3 (t) --> HBO2 + H2O↑ HBO2 + NaCl (t) --> NaBO2 + HCl↑ О свойствах метаборной кислоты HBO2 вы можете посмотреть в статье из Википедии. Здесь направление реакции определяется не константами ионизации (силой кислот), а термодинамическими константами - температурами кипения. Более легкокипящие продукты удаляются из зоны реакции, постоянно сдвигая равновесие вправо. Строго говоря, здесь вытесняется не соляная кислота, а хлороводород. Однако, если улавливать все продукты, то они в сумме и дадут соляную кислоту (HCl + H2O). Что касается реакции хлорида кальция и сернистой кислоты, то она в отличие от вышеуказанной протекает в водном растворе, и для неё можно написать следующую схему равновесия: CaSO3↓ + 2HCl <==> CaCl2 + H2SO3 <==> CaCl2 + H2O + SO2↑ Здесь положение равновесия определяется конкурирующими разнонаправленными реакциями (выпадение осадка CaSO3 и выделение сернистого газа), каждая из которых тянет одеяло на себя. Но в итоге преимущество имеет вторая, так как осадок CaSO3 никуда не девается и остаётся в системе, в то время как сернистая кислота, будучи малоустойчивой, имеет тенденцию к распаду (H2SO3 <==> H2O + SO2↑), поэтому она постоянно удаляется из системы, сдвигая равновесие вправо.
-
Может, уже рванула, но мы узнаем об этом лет через 500. Для нас главное, чтобы Солнце не валяло дурака, а то оно какое-то неспокойное в последнее время.
-
москатель, ты чо такой ехидный?
-
Существует простое школьное правило: сильные кислоты вытесняют более слабые кислоты из их солей. Силу кислот можно сравнить по справочным таблицам констант ионизации (Ка или рКа). Обычно в школе с этим не заморачиваются, а просто запоминают: серная, соляная, азотная - сильные, фосфорная и сернистая - средней силы, угольная и кремниевая - слабые. Но надо помнить, что это правило справедливо только для водных растворов. Для безводного состояния зависимость может быть диаметрально противоположной. Например, фосфорная или борная кислоты могут вытеснять соляную из её солей при нагревании.
-
Не, так не получится. Наоборот, нормальный карбонат MgCO3 при кипячении с водой частично гидролизуется и образует основные соли. Надо поискать методику получения средней соли, если я правильно помню, там что-то связанное с насыщением раствора CO2.
-
Итак, непосредственно из реакционной смеси ничего вразумительного отогнать не удастся, ибо метилацетат образует близкокипящие азеотропные смеси как с метанолом, так и с водой. Подобрать подходящий третий компонент для азеотропной перегонки вам тоже вряд ли удастся. Ниже приведена таблица двухкомпонентных азеотропных смесей для метанола. Вариантов с приемлемым понижением точки кипения (скажем, от 45°С и ниже) совсем мало, и процентное содержание метанола в отгонах мизерное (как правило, всего несколько процентов), а главное - все они для вас недоступны, судя по тому, с каким тщанием вы стараетесь сохранить копеечную уксусную кислоту. Даже если выберете какой-нибудь компонент, то надо будет ещё убедиться, не образует ли он сам азеотропа с водой. А также определиться, что делать дальше с отогнанной азеотропной смесью, как выделять из неё метанол? Так что сам бог велел проводить щелочной гидролиз МА с обратным холодильником, пока весь эфир не гидролизуется. Затем метанол отгоняется из раствора, а ацетат натрия можно пустить на популярный химический опыт "Горячий лёд".
-
А вкус тут при чём? Кстати, я смогу отличить на вкус хлорид бария от хлорида кальция или магния. Пробовал на язык. А вот хлорид стронция мне не попадался. Если препараты бария и стронция чистые, без примесей соединений натрия, кальция, лития, то их можно идентифицировать по окраске пламени: барий - желтовато-зелёная, стронций - карминово-красная.
-
HS- - 2e- = S + H+ (х2) HSO3- + 5H+ + 4e- = S + 3H2O (х1) ---------------------------------------------------------- 2HS- + HSO3- + 3H+ = 3S + 3H2O 2NaHS + NH4HSO3 + 1,5H2SO4 = 3S + Na2SO4 + 0,5(NH4)2SO4 + 3H2O 4NaHS + 2NH4HSO3 + 3H2SO4 = 6S + 2Na2SO4 + (NH4)2SO4 + 6H2O
- 3 ответа
-
- 1
-

-
Храните при низкой температуре в темноте. Протянет с годик, но активность всё равно заметно упадёт. Законсервировать белизну не получится.
-
Точно! Я же об этом знал, но забыл! Память-старушка подвела под монастырь...
-
А с чего вдруг решили, что там аммиачная селитра. Там мочевина и есть (народ обоссал углы старой школы). Мочевина имеет свойство постепенно гидролизоваться с выделением аммиака под воздействием различных факторов, вот и завоняло. Вспомните бесплатные советские сортиры на вокзалах.
-
Отличить ионы бария от стронция можно насыщенным раствором сульфата кальция (гипсовой водой). С ней осадок сульфата бария образуется немедленно, а осадок сульфата стронция только спустя некоторое время. При одновременном присутствии ионов стронция и бария определить стронций не получится, надо будет искать другие пути.
-
Азид натрия очень токсичен, наравне с цианидом. Может всасываться из растворов через кожу. Прежде чем его применять, лучше заранее решить, что потом делать с отработанным раствором, так как от него дохнут не только микроорганизмы, но и более крупная живность. Обычно азиды нейтрализуют нитритом натрия. Нельзя допускать попадания кислот в азиды, так как при этом выделяется летучая и крайне токсичная азидоводородная кислота, которая кроме всего прочего способна жрать металлы, невзирая на ряд напряжений, в том числе и медь. Азиды тяжёлых металлов взрывчаты, некоторые из них даже во влажном виде. В частности, азиды меди (I и II) по чувствительности к механическим воздействиям превосходят азид свинца, который применяется как инициирующее ВВ. Поэтому корпуса капсюлей-детонаторов с азидом свинца никогда не делают медными, а используют алюминий, картон, пластик и т. п.
-
В таком случае, не попробовать ли вносить в почву лимонную кислоту, она вполне доступна, да и требуется её немного. На эту тему в интернете есть куча материалов, забейте в поисковик соответствующий запрос - например так. Думается, что агрохимики и садоводы на своих специализированных форумах смогли бы дать вам более квалифицированные ответы.
-
Нарисуй нам эту задачу 34ю ЕГЭ, а мы сравним свои задачники с нею и выберем те, которые не сильно сложнее.
- 2 ответа
-
- 1
-

-
Ca(H2PO4)2*H2O - моногидрат дигидрофосфата кальция, который согласно химической классификации веществ относится к кислым солям. Соль может быть и безводной. Все соли имеют ионную кристаллическую решётку и при растворении в воде распадаются или, по-научному, диссоциируют на ионы. В данном случае уравнение диссоциации выглядит так: Ca(H2PO4)2 = Ca2+ + 2H2PO4-. Вода в данное уравнение не входит, но её присутствие необходимо, иначе никакой диссоциации не будет. В случае кристаллогидрата молекула воды из него при растворении просто переходит в общий раствор. В виде этих ионов и кальций, и фосфор доступны для усвоения растениями. А почему вас так беспокоит судьба кальция? Я не агрохимик, но мне кажется, что наиболее ценной составляющей этого удобрения является всё-таки фосфор. PS. Пробежавшись галопом по европам в интернете, я понял, что и кальций играет свою роль: благодаря низкой растворимости Ca(H2PO4)2 имеет преимущество над легкорастворимыми гидрофосфатами калия или аммония, которые быстро закисляют почву. Кстати, если будете искать информацию по Ca(H2PO4)2, то имейте ввиду, что одно из часто употребляемых названий для него - монокальцийфосфат.
- 31 ответ
-
- 1
-

-
Что-то я не слыхал такого. Различные мелкие метизы - да. Но чтобы кадмировать жесть - это ЖЕСТЬ! Так ею не только извлекали презренный металл, а ещё много чего делали. Болезнь шляпников






.thumb.png.33740f217bd99edec8e92916d20a2829.png)